近日,我校分子表观遗传学教育部重点实验室在氧化应激与炎症调控研究领域取得重要进展。有氧代谢的生物体时刻面临外界环境和自身代谢产生的活性氧(ROS)的侵袭,细胞内ROS水平超过清除酶系处理能力的氧化状态被称为氧化应激(oxidative stress)。氧化应激会导致细胞内各种生物大分子(包括蛋白质、脂质及核酸)的氧化。针对这一问题,早期研究过多地强调了ROS对机体的毒害作用,研究团队的研究发现精准调控的ROS作为信号分子,参与了生理、病理条件下细胞的基因表达、代谢调控、迁移、分化等多种生物学过程。相关研究成果近期连续发表在国际著名期刊《美国国家科学院院刊》 (PNAS)上。
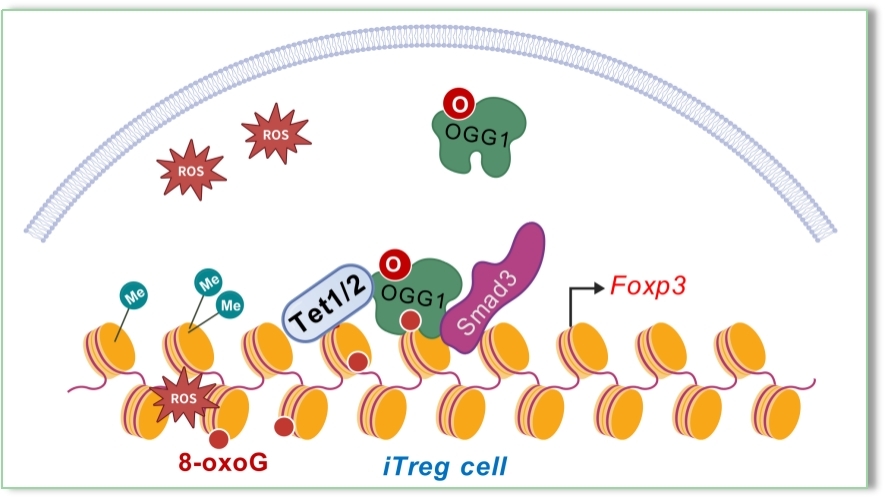
研究团队以发挥抑炎作用的调节性T细胞(Treg)为研究对象,揭示了Treg分化过程中产生的大量ROS可导致8-羟鸟嘌呤DNA糖苷酶1(OGG1)发生氧化,使其关闭原本的修复氧化DNA损伤(8-羟鸟嘌呤)的功能,转而特异性地结合在Treg核心转录因子Foxp3基因启动子区,通过招募转录因子Smad3以及促进该区域的DNA去甲基化的双重机制增强Foxp3基因表达,进而促进Treg分化。靶向OGG1的小分子抑制剂O8通过促进Treg分化有效缓解炎症性肠病(IBD)。该研究不仅阐明了OGG1作为识别DNA氧化这一古老的表观遗传修饰的“读者”,能够响应ROS的刺激通过精细调控基因表达参与炎症过程的调节;也揭示了OGG1抑制剂在IBD等自身免疫性疾病治疗中的重要转化意义。相关成果以“OGG1 augments the transcriptional activation of Foxp3 to promote iTreg differentiation for IBD alleviation”为题,发表在国际著名期刊《美国国家科学院院刊》 (PNAS)上。我校分子表观遗传学教育部重点实验室田苗苗博士、郝凤奇博士和王新宇硕士为该成果的共同第一作者,巴雪青教授和魏民教授为共同通讯作者。
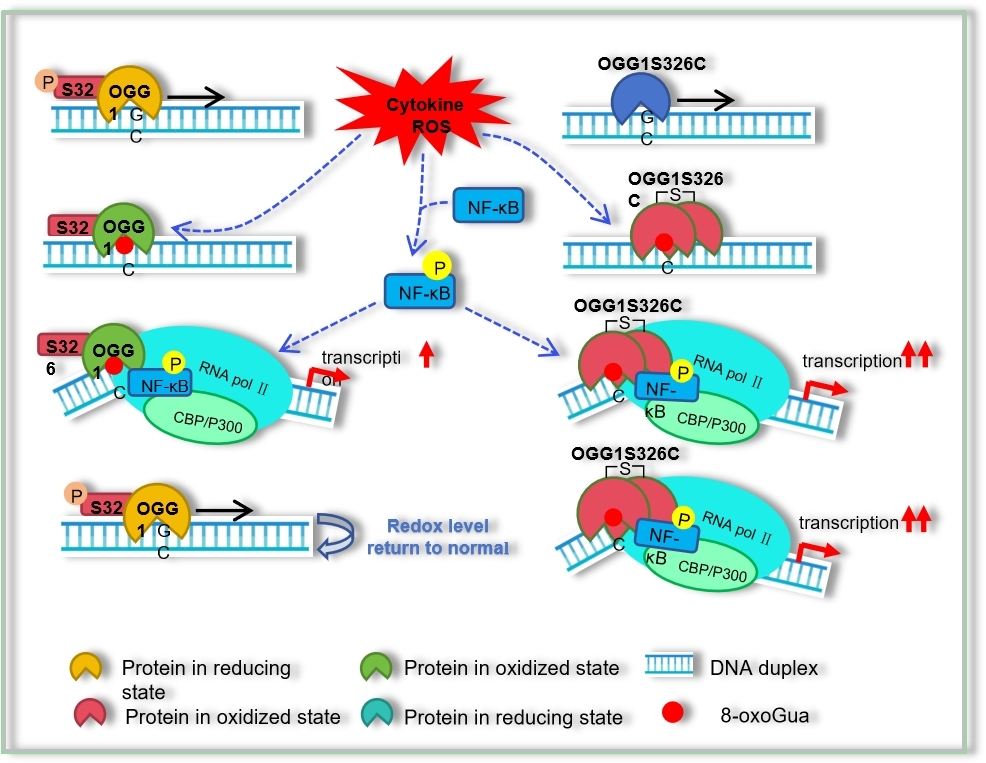
研究团队进一步深入解析了OGG1S326C变体在基因转录中的作用机制:OGG1在自然状态下就存在多种单核苷酸多态(single nucleotide polymorphic, SNP)。其中,第326等位丝氨酸突变为半胱氨酸(OGG1S326C)的频率在白种人中为23%至41%,在亚洲人中高达40%至60%,与147种疾病有关。该研究揭示了OGG1S326C携带个体易感肺炎的内在机制。OGG1第326位的丝氨酸会被CDK4组成性磷酸化,保证其发挥DNA损伤修复功能。而响应炎症信号刺激时,OGG1这一位点的磷酸化需要去除才能转而发挥基因转录调控功能。相比之下,OGG1S326C不仅不需要去磷酸化,而且由于半胱氨酸(C)容易被ROS氧化而发生二聚化,使其与DNA的结合能力增强,因此极大地促进了OGG1对炎症因子和趋化因子的转录调控作用,从而加重肺部炎症。OGG1的小分子抑制剂可以显著降低炎性基因的表达和肺炎症状。该研究阐明了携带OGG1S326C变体的个体疾病易感性增加的分子基础,并提出了OGG1抑制剂在缓解炎症驱动的病理方面的治疗潜力。相关成果以“OGG1S326C variant frequent in human populations facilitates inflammatory responses due to its extended interaction with DNA substrate”为题,发表在国际著名期刊《美国国家科学院院刊》 (PNAS)上。我校分子表观遗传学教育部重点实验室韩金玲博士为该成果的第一作者,巴雪青教授为通讯作者。
相关论文链接:
https://www.pnas.org/doi/epdf/10.1073/pnas.2424733122
https://www.pnas.org/doi/epub/10.1073/pnas.2426102122
初审:王俊锋
复审:解悦
终审:郑伟